アンモニウム
アンモニウム(ammonium)は、化学式NH4+の分子イオンである[1]。 アンモニア(NH3)のプロトン化によって形成されるオニウムイオンである。 アンモニウムは、NH4+の1つ以上の水素原子が有機基に置き換わってできる、陽電荷を持った、またはプロトン化置換基を持つアミンや、第四級アンモニウムカチオン(NR4+)に対する一般名でもある。「アンモニウムイオン」とも呼ばれるが、「アンモニウム」という用語自体がイオンの名前である。
| アンモニウム | |
|---|---|
| |

|

|
Ammonium | |
| 識別情報 | |
| CAS登録番号 | 14798-03-9 |
| PubChem | 16741146 |
| ChemSpider | 218 |
| MeSH | D000644 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | NH+ 4 |
| モル質量 | 18.03851 g mol−1 |
| 構造 | |
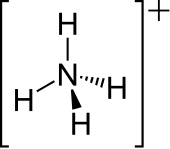
| 分子の形 | 正四面体型 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
酸塩基反応
編集アンモニウムは、弱塩基であるアンモニアがブレンステッド酸(プロトンドナー)と反応して形成される。
の酸解離定数pKaは、9.25である。
アンモニウムイオンは弱酸性で、ブレンステッド塩基と反応して無電荷のアンモニア分子に戻る。
従って、アンモニウム塩の濃溶液を強塩基で処理するとアンモニアを生じる。アンモニアが水に溶けると、そのうち少量がアンモニウムイオンに変わる。
アンモニアがアンモニウムイオンを形成する割合は、溶液のpHに依存する。pHが低い時は平衡は右に動き、より多くのアンモニアがアンモニウムイオンに変わる。pHが高い、つまり水素イオン濃度が低ければ平衡は左に動き、水酸化物イオンがアンモニウムイオンからプロトンを引き抜き、アンモニアを形成する。
アンモニウム化合物の形成は、気相でも起きる。例えば、アンモニア蒸気が塩化水素蒸気と接すると、塩化アンモニウムの白雲が形成され、最終的には、固相の白く薄い層となる。
アンモニウム塩
編集アンモニウムイオンは、炭酸アンモニウム、塩化アンモニウム、硝酸アンモニウム等の様々な塩で見られる。大部分の単純なアンモニウム塩は、非常に溶解性が高い。例外はヘキサクロリド白金(IV)酸アンモニウムで、かつては、これを生成させることでアンモニウムを検出していた。硝酸塩や過塩素酸塩は爆発性が高く、この場合はアンモニウムは還元剤となる。
アンモニウムイオンがアマルガムを形成する場合もある。これは、アンモニウム溶液を水銀電極を用いて電気分解した場合に生じる[2]。このアマルガムは最終的に分解してアンモニアと水素を放出する[3]。
構造と結合
編集アンモニアの窒素原子の孤立電子対は、水素と結合を形成する。その後、4つ全てのN-H結合は等価になり、極性共有結合になる。このイオンは、メタン及びテトラヒドリドホウ酸イオンと等電子的である。イオン半径(rionic = 175 pm)は、セシウムの陽イオン(rionic = 183 pm)と近い。
検出
編集それに金属水酸化物を加えると、アンモニアが生成される。
有機アンモニウムイオン
編集アンモニウムイオンの水素原子は、アルキル基または他の有機基で置換され、置換アンモニウムイオン(IUPAC名ではアミニウムイオン)を形成することができる。有機基の数に依って、アンモニウムイオンは、第一級から第四級と呼ばれる。第四級アンモニウムイオンを除き、有機アンモニウムイオンは弱酸性である。
アンモニウムイオンを形成する反応の例としては、ジメチルアミン((CH3)2NH)と酸の反応があり、ジメチルアミニウムイオン((CH3)2NH2+)を生じる。
第四級アンモニウムイオンでは、窒素原子に4つの有機基が結合しており、窒素原子に直接結合する水素原子はない。テトラ-n-ブチルアンモニウムブロミドのようなこれらのイオンは、陰イオンの有機溶媒への可溶性を向上させるために、ナトリウムイオンやカリウムイオンと置換されることがある。第一級から第三級アンモニウムイオンも同様の性質を持つが、親油性は弱い。相間移動触媒や界面活性剤としても用いられる。
生物学
編集アンモニウムイオンは、動物の代謝における老廃物である。魚類や水棲無脊椎動物では、水中に直接排泄される。哺乳類、サメ、両生類では、毒性を低くし貯蔵を容易にするために、尿素回路で尿素に変換される。鳥類、爬虫類、陸棲カタツムリでは、固体であるため最小限の水で排泄できる尿酸に変換される[4]。
アンモニウムは、多くの植物、特に低酸素土壌で生育するものにとっては、重要な窒素源である。しかし、穀物にとっては毒でもあり、単一の窒素源として用いられることは滅多にない[5]。
アンモニウム金属
編集アンモニウムイオンは、重アルカリ金属と非常に似た性質を持ち、しばしば近い関係にあると考えられる[6][7][8]。アンモニウムは、天王星や海王星のような木星型惑星の内部等の超高圧の環境下では、金属として振る舞うと考えられる[7][8]。
関連項目
編集出典
編集- ^ 代置命名法においては、NH4+はアザニウム(azanium)と呼ばれる。
- ^ Pseudo-binary compounds
- ^ "Ammonium Salts". VIAS Encyclopedia.
- ^ Campbell, Neil A.; Jane B. Reece (2002). “44”. Biology (6th ed.). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 0-8053-6624-5
- ^ Britto, DT; Kronzucker, HJ (2002). “NH4+ toxicity in higher plants: a critical review”. Journal of Plant Physiology 159 (6): 567–584. doi:10.1078/0176-1617-0774.
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ a b Stevenson, D. J. (November 20, 1975). “Does metallic ammonium exist?”. Nature (Nature Publishing Group) 258: 222–223. Bibcode: 1975Natur.258..222S. doi:10.1038/258222a0 January 13, 2012閲覧。.
- ^ a b Bernal, M. J. M.; Massey, H. S. W. (February 3, 1954). “Metallic Ammonium”. Monthly Notices of the Royal Astronomical Society (Wiley-Blackwell for the Royal Astronomical Society) 114: 172–179. Bibcode: 1954MNRAS.114..172B January 13, 2012閲覧。.