B-ćelija

B-ćelije, poznate i kao B-limfociti, tipovi su bijelih krvnih zrnaca, podtipa limfocita.[1][2][3] Njihova funkcija je uloga je uključenost u humoralne imunosti adaptivnog imunskog sistema putem lučenje antitijela. Pored toga, B-ćelije prezentiraju antigene (i klasificirane su kao profesionalne ćelije koje prezentiraju antigen - APC) i luče citokine.[4]
Kod sisara, B-ćelije dozrijevaju u koštanoj srži, koja je jezgro većine kostiju.[5] Kod ptica, B-ćelije zriju u Fabriciusovim kesicama, koje su limfoidni organi. ( "B" oblik B-ćelija dolazi od imena ovog organa), koga je prvi otkrili Chang i Glick, a ne od a termina koštana srž (engleski Bone marrow), kao što se općenito vjeruje.
B-ćelije, za razliku od druge dvije klase limfocita, T-limfocita i prirodnih ćelija ubica, ispoljavaju receptore B-ćelija (BCR) na ćelijskoj membrane. BCR dozvoljavaju B-ćeliji molekulsko vezanje specifičnih antigena, protiv kojih će pokrenuti odgovor putem antitijela.[2]
Razvoj
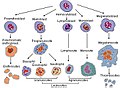
[uredi | uredi izvor]B-ćelije se razvijaju od krvotvornih matičnih ćelija(HSCs) , koje potječu iz koštane srži.[6] HSCs first differentiate into multipotent progenitor (MPP) cells, then common lymphoid progenitor (CLP) cells.[6] Odavde, njihov razvoj u B-ćelije se odvija u nekoliko faza (prikazano na slici sa desne strane), svaka u znaku različitim obrascima ekspresije gene i imunoglobulinskog teškog (H) lanca i L lanca, aranžmanom genskih lokusa , a kasnije , kako se razvijaju, B-ćelije prolaze kroz V(D)Jrekombinacije.[7]
Dok se razvijaju u koštanoj srži, B-ćelije prolazi kroz dvije vrste selekcije, kako bi se osigurao pravilan razvoj. Pozitivna selekcija nastaje kroz antigen-nezavisna signalizaciju, uključujući i pre-BCR i BCR.[8][9] Ako se ovi receptori ne vežu za svoje ligande, B-ćelije ne dobijaju odgovarajuće signale i prestaju da se razvijaju. Negativna selekcija se javlja putem vezanja sopstvenog antigena sa BCR. Ako BCR može snažno vezati za taj antigen, onda je B-ćelija prolazi kroz jednu od četiri sudbine:
- klonska delecija,
- uređivanje receptora,
- klonska anergija, ili
- ignoriranje (ćelija ignorira B-signal i nastavlja razvoj).
Ovaj proces negativne selekcije dovodi u stanje zvano centralna tolerancija, u kojoj zrele B-ćelije uz sebe ne vežu antigene koji su prisutni u koštanoj srži.[2] Da bi se dovršio razvoj, nezrele B-ćelije migriraju iz koštane srži u slezenu i prolaze kroz dvije tranzicijske faze: T1 i T2.[10] Tokom njihovih migracijama u slezenu i nakon stupanja u slezenu, oni se smatraju B-ćelijama T1.[11] . U slezeni, T1 B-ćelija prelazi u T2 B-ćelije. T2 B-ćelije se diferenciraju u folikul (FO) B-ćelije ili marginalne zone (MZ) B-ćelija, u zavisnosti od signala, koji su primljene preko BCR i drugih receptora.[12] Once differentiated, they are now considered mature B cells, or naive B cells.[11]
Dok su nezrele i tokom faze T1, B-ćelije ispoljavaju TCR CR klasu IgH, ali ekspresija BCR ih mijenja u klase IgM i IgD, nakon prelaska u fazu T2 i dok dospijevaju do aktiviranja.
Aktivacija
[uredi | uredi izvor]
Aktivacija B-ćelija se javlja u sekundarnim limfnim organima (SLOS), kao što su slezena i limfni čvorovi. Nakon sazrijervanja B-ćelija u koštanoj srži, one migriraju putem krvI u SLOS, koji primaju stalni dotok antigena putem cirkulacije limfe.[13] At the SLO, B cell activation begins when the B cell binds to an antigen via its BCR.[14] Antigen može biti slobodno-plutajući ili predstavljen kao APC, kao što su makrofagi ili dendritske ćelije (DC), a uključuju proteine, glikoproteine, polisaharide, cijele virusne čestice i cijele bakterijske ćelije. Od tri podskupa, B FO B-ćelije prvenstveno prolaze aktivaciju koja je zavisna od T-ćelija, dok MZB-limfociti i B1- B-ćelije prvenstveno prolaze aktivaciju koja je nezavisna od T-ćelija.[15]

Aktivacija B-ćelija je poboljšana pomoću aktivnost CD21, površinskog receptora u kompleksu sa površinom proteina CD19 i CD81 (sva tri su skuno poznata kao koreceptorski kompleks B-ćelije).[16] Kada BCR veže antigen označeno fragmentom C3, komplemntni protein CD21 veže C3 fragment, skupa vezan sa vezom BCR, a signali se prnose kroz CD19 i CD81 na niže pragove aktiviranja ćelije.[17]
Aktivacija koja zavisi od T-ćelija
[uredi | uredi izvor]Antigeni koji aktiviraju B-ćelije bez pomoći T-ćelija su poznati kao T-ćelijski-nezavisni (TI) antigeni, a uključuju strane polisaharide i nemetiliranu CpG DNK. Imenuju se tako zato što su sposobni podstaći humoralni odgovor u organizmima koji je izgubili T-ćelije. Odgovor B-ćelija na takve antigene je brz, pomoću antitijela čije generiranje usmjereno na manje funkcionalno svestrane od onih koje su ostvarene aktivacijom koja je ovisna o T-ćelijama.[2]
Kao i kod TD antigena, B-ćelijama, koje su aktivirane TI antigenima, potrebni su dodatni signali da završe aktiviranje, ali umjesto da ih primaju iz T-ćelija, oni ih prepoznaju i vežu za uobičajeni mikrobiološki konstituent u duguljastim receptorima (TLRs) ili opsežno umrežavanje u BCR za ponavljanje epitopa na bakterijskoj ćeliji. B-ćelije koje su aktivirane TI antigenima dalje da umnožavaju izvan limfnog folikula, ali i dalje u SLOS (ne formiraju se GC), pa eventualno prolaze promjenu imunoglobulinske klase, i diferenciraju se u kratkotrajna plazmablaste koji proizvode rana, slaba antitijela, uglavnom klase IgM, ali i neke grupe dugotrajnih plazma-ćelija.[18]
Aktivacija koja ne zavisi od T-ćelija
[uredi | uredi izvor]Imenovanje ovakve aktivacije potiče od nesposobnosti B-ćelija da izazovu humoralni odgovor u organizmima kojima nedostaju T-ćelije. Odgovor B-ćelija na ove antigene traje više dana, putem novonastalih antitijela sa višim afinitetom i funkcijski mnogo svestranijim od onih koje su aktivirane nezavisno od T-ćelija.
Odmah uspostavljena BCR veza TD antigena, uzima antigen u B-ćelije, putem endocitoze koju posreduje receptora degradiran i predstavljen T-ćelijama kao peptidni komad u kompleksu sa molekulama MHC-II na ćelijskoj membrani.[19] T helper (TH)ćelije, tipski folikulska T-helper (TFH) ćelije, koje se aktiviraju istim antigenom koji prepoznaje i veže ove komplekse MHC-II-peptid, pomoću receptora T-ćelija (TCR).[20] Slijedeći vezu TCR-MHC-II-peptid, T-ćelije ispoljavaju površinski protein CD40L, kao i citokine tipa IL-4 i IL-21. CD40L je potreban kao kostimulacijski faktor za aktivaciju B-ćelija putem vezanja njihovog površinskog receptora CD40, koji promovira umnožavanje B-ćelija, promjenu klase imunoglobulina i somatsku hipermutaciju, kao i održiv rast T-ćelija i diferencijaciju. Citokini koji su izvedeni iz T-ćelija sa citokinskim receptorom B-ćelija takođe podstiče proliferaciju B-ćelija, promjenu klase immunoglobulina i somatske hipermutacije, kao i vodiče diferencijacije. Nakon što B-ćelije prime signale, smatraju se aktiviranim.
Aktivirane B-ćelije učestvuju u procesu diferencijacije u dva koraka, čiji rezultat su kratkoživući plazmablaste za brzu zaštitu, dugoživeće plazmacite i memorijske B-ćelije za dugotrajnu zaštitu. Prvi korak, poznat kao vanfolikulski odgovor, javlja se van limfnih folikula, ali u okviru but SLO. Tokom ovog koraka, aktivirana proliferacija B-ćelija, može proći promjenu imunoglobulinske klase i diferencirati se u plazmablaste koji proizvode rana, slaba antitijela, koja su pretežno klase IgM.[21] Drugi korak se sastoji od aktiviranja ulaska B-ćelija u limfni folikul i formiranje germinalnog centar (GC), koji je specijaliziran mikrosredinu gdje B-ćelije prolaze kroz opsežne proliferaciju, promjenu imunoglobulinske klase i sazrijevanje afiniteta usmjerenog somatskim hipermutacijama.[22] Ovi procesi su oblikovani preko TFH-ćelija unutar GC, a generiraju B-memorijske ćelije sa visokim afinitetom i dugoživeće plazmacite. Rezultanta lučenja plazmacita je velika količina antitijela koja ostaju unutar SLO ili, more češće, migriraju u koštanu srž.
Aktivacija memorijskih B-ćelija
[uredi | uredi izvor]Aktiviranje memorijskih B-ćelija počinje otkrivanjem i vezanjem njihovih ciljnih antigena, koji se dijele po roditeljima B-ćelija.[23] Neke memorijske B-ćelije se mogu aktivirati bez pomoći T-ćelija, kao što su određene memorijske virusno specifične B-ćelije, ali drugima je potrebna pomoć T-limfocita. Nakon vezanja antigena, memorijske B-ćelije zauzimaju antigen putem endocitoze koja je posredovana receptorom, degradira ga i predstavlja u T-ćelijama, kao komad peptida u kompleksu sa molekulama MHC-II na ćelijskoj membrani. Memorijske T-helper (TH) ćelije, obično memorijske folikulske T-helper (TFH) ćelije, koje su izvedene iz T-ćelija, aktivirane istim antigenom, prepoznaju i vežu ove MHC-II-peptidne komplekse putem svog receptora TCR. Nakon vezanja TCR-MHC-II-peptida i releja drugih signala iz memorijskih TFH ćelija, memorijske B-ćelije se aktiviraju i diferenciraju u plazmablaste i plazma-ćelije, preko vanfolikulskog odgovora ili reakcije ulaza germinalnog centra, u kojoj se stvaraju plazma-ćelije i više memorijskih B-ćelija. Nejasno je da li, unutar ovih sekundarnih GC, memorijske B-ćelije dalje prolaze kroz sazrijevanje afiniteta.[2]
Vrste B-ćelija
[uredi | uredi izvor]- Plazmablasti su ćelije kratkog vijeka, koje se uvišestručavaju i luče antitijela. Nastaju diferencijacijom B-ćelija. Nakon infekcije stvaraju se već u ranoj fazi odgovora, a njihova antitijela su sklona slabijem afinitetu prema njihovim ciljnim antigenima, u poređenju sa plazmacitima. Plazmablasti mogu nastati i od B-ćelija koje su aktivirane nezavisno od T-ćelija ili vanfolikulskim odgovorom aktivacije B-ćelija koja zavisi od T-ćelija.
- Plazma-ćelije su dugoživuće B-ćelije, koje se ne uvišestručavaju, ali luče antitijela, a koje nastaju diferencijacijom B-ćelija. Postoje dokazi da se B-ćelije prvo diferenciraju u ćelije koje liče na plazmablaste, a zatim u plazmacite. Plazma-ćelije se generiraju kasnije, a poredeći ih sa plazmablastima, imaju antitijela sa visokim afinitetom protiv ciljnih antigena sto nastaje pod uticajem afiniteta sazrijevanja u germinalnom centru (GC) i proizvodnji više antitijela. Plazmmaciti obično nastaju iz reakcije germinalnog centra od aktiviranih B-ćelija, koje zavise od T-ćelijske aktivacije; međutim, mogu također nastati i od B-ćelija koje su netavisne od aktivacije putem T (ćelija).
- Memorijske B-ćelije su neaktivne ili spavajuće B-ćelija koje nastaju diferencijacijom B-ćelija. Njihova funkcija je da cirkuliraju kroz tijelo i pokreću jači i brži odgovor antitijela (poznat i kao odgovor sekundarnih antitijela), ako se otkrije antigen koji je aktivirao njihovu roditeljsku B-ćeliju (memorijake B-ćelije i njihove roditeljske B-ćelije imaju isti BCR, tako da otkrivaju isti antigen.[24] Memory B cells can be generated from T cell-dependent activation through both the extrafollicular response and the germinal center reaction as well as from T cell-independent activation of B1 cells.[24]
- Folliculska (FO) B-ćelije (poznate kao B-2 ćelije) su nauobičajeniji tip B-ćelija i, kada ne cirkuliraju u krvi, pretežno se nalaze u limfnim folikulima sekundarnih limfnih organa (SLO). Odgovorne su za stvaranje glavnine visokoafiniretnih antilijela tokom infekcije.
- B-ćelije sa marginalnom zonom (MZ) B, uglavnom se nalaze u marginalnoj zoni slezene, a služe kao prva linija odbrane protiv patogena koji nastaju u krvi, kao marginalna zona koja prima velike količine krvi iz cirkulacije.[25] Oni mogu proći i T-ćelije nezavisno i T limfocita-ovisna aktivacija, ali prvenstveno prolazei kroz aktivaciju koja zavisna ili onu koja je nezavisna T-ćelija, ali pretežno kroz nezavisnu.
- Ćelije B-1 nastaju u putu razvoja koji se razlikuje od puta FO-B i MZ- B-ćelija.[26] Kod miša, predominiraju u peritoneumskoj i pleuralnoj šupljini, generirajući prirodna antitijela (proizvedena bez infekcije), braneći se protiv patogena sluzokože i primarno ispoljavaju aktivaciju koja je nezavisna od T-ćelija. Pravi homolog mišjih B-1 ćelija nije otkriven kod ljudi, iako su opisane različite populacije ćelija koje su slične B-1 ćelijama.
- B-2 ćelije - FO- B-ćelije i MZ- B-ćelije su jedan od nedovoljno opisanih tipova B-ćelija.
- Regulatorne B (Breg) ćelije su imunosupresivni tip B-ćelija koje zaustavljaju širenje patogena, pro-upalnoh limfocita putem lučenja IL-10, IL-35 i TGF-β.[27] Također, promovira stvaranje regulatornih T (Treg) ćelija direktno u interakciji s T-ćelijama, skretajući njihovu diferencijaciju prema T-regulaciji. Nema opisanih zajedničkih identiteta sa Breg (B-reguliranim) ćelijama. Mnogi podskupovi B-reg ćelija, koji imaju zajedničke regulatorne funkcije, pronađeni su i kod miševa i kod ljudi. Trenutno nije poznato da li su podskupovi Breg ćelija razvojno povezani i kako se tačno odvija diferencijacija B-reg ćelije. Postoje dokazi koji pokazuju da gotovo sve vrste B-ćelija mogu diferencirati u Breg ćeliju pomoću mehanizama koji uključuju upalne signale i prepoznavanje BCR.
Patologija u vezi sa B-ćelijama
[uredi | uredi izvor]Posljedica nenormalnog prepoznavanja B-ćelija za vlastite antigene, može biti autoimuna bolest, nakon čega slijedi proizvodnja autoantitijela. Autoimune bolesti kod kojih je aktivnost bolesti povezana sa aktivnošću B ćelija obuhvataju: sklerodermu, multiplu sklerozu, sistemski eritematozni lupus, dijabetes tipa 1 i reumatoidni artritis. [28]
Maligna transformacija B-ćelija i njihovih prekursora može izazvati pojavu mjesta za kancere, među kojima su: hroničnu limfocitnu leukemiju (CLL), akutnu limfoblastnu leukemiju (ALL), ćelijsku leukemiju, folukulski limfom, Ne-Hodgkinov limfom i Hodgkinov limfom, te zloćudne ćelije plazme poput multipla mijeloma, Waldenströmova makroglobulinemija i određeni oblici amiloidoze.[29]
Studija koja je istraživala metilom B-ćelija tokom ciklusa diferencijacije, koristeći bisulfitno sekvenciranje cijelog genoma (WGBS), pokazala je da hipometilacija postoji od najranijih do najviše diferenciranih faza. Najveća metilacijska razlika je bila između faze germinalnog centra B-ćelija i memorijskih B-ćelija. Osim toga, ova studija je pokazala da postoji sličnost između B-ćelija tumora i dugotrajnih B-ćelija u znacima metilacije DNK.[30]
Dodatne slike
[uredi | uredi izvor]-
Hematopoeza krvnih ćelija
-
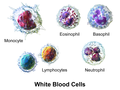
3D prikaz tipova bijelih krvnih zrnaca
-
Plazma-ćelija
-
Signalizacija receptora B-ćelija
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Međedović S., Maslić E., Hadžiselimović R. (2002). Biologija 2. Svjetlost, Sarajevo. ISBN 9958-10-222-6.CS1 održavanje: više imena: authors list (link)
- ^ a b c d e Hadžiselimović R., Pojskić N. (2005). Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 9958-9344-3-4.
- ^ Murphy, Kenneth (2012). Janeway's Immunobiology 8th Edition. New York, NY: Garland Science. ISBN 9780815342434.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
- ^ Cooper, Max D. (1. 1. 2015). "The early history of B cells". Nature Reviews Immunology. 15 (3): 191–7. doi:10.1038/nri3801. PMID 25656707.
- ^ a b Kondo, Motonari (1. 11. 2010). "Lymphoid and myeloid lineage commitment in multipotent hematopoietic progenitors". Immunological Reviews. 238 (1): 37–46. doi:10.1111/j.1600-065X.2010.00963.x. ISSN 1600-065X. PMC 2975965. PMID 20969583.
- ^ Pelanda, Roberta; Torres, Raul M. (1. 4. 2012). "Central B-Cell Tolerance: Where Selection Begins". Cold Spring Harbor Perspectives in Biology. 4 (4): a007146. doi:10.1101/cshperspect.a007146. ISSN 1943-0264. PMC 3312675. PMID 22378602.
- ^ Martensson, Inga-Lill; Almqvist, Nina; Grimsholm, Ola; Bernardi, Angelina (2010). "The pre-B cell receptor checkpoint". FEBS Letters. 584 (12): 2572–9. doi:10.1016/j.febslet.2010.04.057. PMID 20420836.
- ^ LeBien, Tucker W.; Tedder, Thomas F. (1. 9. 2008). "B lymphocytes: how they develop and function". Blood. 112 (5): 1570–1580. doi:10.1182/blood-2008-02-078071. ISSN 0006-4971. PMC 2518873. PMID 18725575.
- ^ Loder, By Florienne; Mutschler, Bettina; Ray, Robert J.; Paige, Christopher J.; Sideras, Paschalis; Torres, Raul; Lamers, Marinus C.; Carsetti, Rita (1. 7. 1999). "B Cell Development in the Spleen Takes Place in Discrete Steps and Is Determined by the Quality of B Cell Receptor–Derived Signals". The Journal of Experimental Medicine. 190 (1): 75–90. doi:10.1084/jem.190.1.75. ISSN 0022-1007. PMID 10429672.
- ^ a b Chung, James B.; Silverman, Michael; Monroe, John G. (6. 1. 2003). "Transitional B cells: step by step towards immune competence". Trends in Immunology. 24 (6): 342–348. doi:10.1016/S1471-4906(03)00119-4. ISSN 1471-4906.
- ^ Cerutti, Andrea; Cols, Montserrat; Puga, Irene (1. 1. 2013). "Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes". Nature Reviews Immunology. 13 (2): 118–32. doi:10.1038/nri3383. PMC 3652659. PMID 23348416.
- ^ Harwood, Naomi E.; Batista, Facundo D. (1. 1. 2010). "Early Events in B Cell Activation". Annual Review of Immunology. 28 (1): 185–210. doi:10.1146/annurev-immunol-030409-101216. PMID 20192804.
- ^ Yuseff, Maria-Isabel; Pierobon, Paolo; Reversat, Anne; Lennon-Duménil, Ana-Maria (1. 1. 2013). "How B cells capture, process and present antigens: a crucial role for cell polarity". Nature Reviews Immunology. 13 (7): 475. doi:10.1038/nri3469. PMID 23797063.
- ^ Nutt, Stephen L.; Hodgkin, Philip D.; Tarlinton, David M.; Corcoran, Lynn M. (1. 1. 2015). "The generation of antibody-secreting plasma cells". Nature Reviews Immunology. 15 (3): 160. doi:10.1038/nri3795. PMID 25698678.
- ^ Asokan, Rengasamy; Banda, Nirmal K.; Szakonyi, Gerda; Chen, Xiaojiang S.; Holers, V. Michael (1. 1. 2013). "Human complement receptor 2 (CR2/CD21) as a receptor for DNA: Implications for its roles in the immune response and the pathogenesis of systemic lupus erythematosus (SLE)". Molecular Immunology. 53 (1–2): 99–110. doi:10.1016/j.molimm.2012.07.002. PMC 3439536. PMID 22885687.
- ^ Zabel, Mark D.; Weis, John H. (1. 3. 2001). "Cell-specific regulation of the CD21 gene". International Immunopharmacology. Unraveling Mechanisms and Discovering Novel Roles for Complement. 1 (3): 483–493. doi:10.1016/S1567-5769(00)00046-1. PMID 11367532.
- ^ Bortnick, Alexandra; Chernova, Irene; Quinn, William J.; Mugnier, Monica; Cancro, Michael P.; Allman, David (1. 6. 2012). "Long-Lived Bone Marrow Plasma Cells Are Induced Early in Response to T Cell-Independent or T Cell-Dependent Antigens". The Journal of Immunology. 188 (11): 5389–5396. doi:10.4049/jimmunol.1102808. ISSN 0022-1767. PMC 4341991. PMID 22529295.
- ^ Blum, Janice S.; Wearsch, Pamela A.; Cresswell, Peter (1. 1. 2013). "Pathways of Antigen Processing". Annual Review of Immunology. 31 (1): 443–473. doi:10.1146/annurev-immunol-032712-095910. PMC 4026165. PMID 23298205.
- ^ Crotty, Shane (1. 1. 2015). "A brief history of T cell help to B cells". Nature Reviews Immunology. 15 (3): 185–9. doi:10.1038/nri3803. PMC 4414089. PMID 25677493.
- ^ MacLennan, Ian C. M.; Toellner, Kai-Michael; Cunningham, Adam F.; Serre, Karine; Sze, Daniel M.-Y.; Zúñiga, Elina (1. 8. 2003). "Extrafollicular antibody responses". Immunological Reviews. 194: 8–18. ISSN 0105-2896. PMID 12846803.
|first7=nedostaje|last7=(pomoć) - ^ Shlomchik, Mark J.; Weisel, Florian (1. 5. 2012). "Germinal center selection and the development of memory B and plasma cells". Immunological Reviews. 247 (1): 52–63. doi:10.1111/j.1600-065X.2012.01124.x. ISSN 1600-065X. PMID 22500831.
- ^ McHeyzer-Williams, Michael; Okitsu, Shinji; Wang, Nathaniel; McHeyzer-Williams, Louise (1. 1. 2011). "Molecular programming of B cell memory". Nature Reviews Immunology. 12 (1): 24–34. doi:10.1038/nri3128. PMC 3947622. PMID 22158414.
- ^ a b Kurosaki, Tomohiro; Kometani, Kohei; Ise, Wataru (1. 1. 2015). "Memory B cells". Nature Reviews Immunology. 15 (3): 149. doi:10.1038/nri3802. PMID 25677494.
- ^ Pillai, Shiv; Cariappa, Annaiah; Moran, Stewart T. (1. 1. 2005). "Marginal Zone B Cells". Annual Review of Immunology. 23 (1): 161–196. doi:10.1146/annurev.immunol.23.021704.115728. PMID 15771569.
- ^ Baumgarth, Nicole (1. 1. 2010). "The double life of a B-1 cell: self-reactivity selects for protective effector functions". Nature Reviews Immunology. 11 (1): 34–46. doi:10.1038/nri2901. PMID 21151033.
- ^ Rosser, Elizabeth C.; Mauri, Claudia (2015). "Regulatory B Cells: Origin, Phenotype, and Function". Immunity. 42 (4): 607–612. doi:10.1016/j.immuni.2015.04.005. ISSN 1074-7613. PMID 25902480.
- ^ Yanaba, Koichi; Bouaziz, Jean-David; Matsushita, Takashi; Magro, Cynthia M.; St.Clair, E. William; Tedder, Thomas F. (1. 6. 2008). "B-lymphocyte contributions to human autoimmune disease". Immunological Reviews. 223 (1): 284–299. doi:10.1111/j.1600-065X.2008.00646.x. ISSN 1600-065X.
- ^ III, Arthur L. Shaffer; Young, Ryan M.; Staudt, Louis M. (1. 1. 2012). "Pathogenesis of Human B Cell Lymphomas". Annual Review of Immunology. 30 (1): 565–610. doi:10.1146/annurev-immunol-020711-075027. PMID 22224767.
- ^ Kulis, Marta; Merkel, Angelika; Heath, Simon; Queirós, Ana C.; Schuyler, Ronald P.; Castellano, Giancarlo; Beekman, Renée; Raineri, Emanuele; Esteve, Anna (1. 7. 2015). "Whole-genome fingerprint of the DNA methylome during human B cell differentiation". Nature Genetics (jezik: engleski). 47 (7): 746–756. doi:10.1038/ng.3291. ISSN 1061-4036.