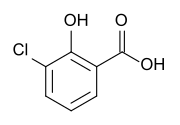
3-Chlorsalicylsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Chlorsalicylsäure | ||||||||||||||||||
| Andere Namen |
3-Chlor-2-hydroxybenzoesäure | ||||||||||||||||||
| Summenformel | C7H5ClO3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 172,57 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
3-Chlorsalicylsäure ist eine chemische Verbindung, die sowohl zur Stoffgruppe der Phenole als auch zur Stoffgruppe der aromatischen Carbonsäuren gehört.
Darstellung
[Bearbeiten | Quelltext bearbeiten]3-Chlorsalicylsäure kann nicht direkt aus Salicylsäure gewonnen werden, da die bevorzugte Substitutionsrichtung die Position 5 ist. Deshalb wird zunächst eine Sulfonsäuregruppe eingeführt, dann die Chlorierung durchgeführt und schließlich desulfoniert.[2]

Ferner ist die Synthese über eine Reimer-Tiemann-Reaktion und anschließende Oxidation des entstehenden Aldehyds mit Silberoxid möglich.[3]

Eine Kolbe-Schmitt-Reaktion mit 2-Chlorphenol liefert ebenfalls 3-Chlorsalicylsäure, jedoch in geringer Ausbeute.[4]

Reaktionen
[Bearbeiten | Quelltext bearbeiten]Durch Oxidation mit Kaliumpersulfat entsteht aus 3-Chlorsalicylsäure die 3-Chlorgentisinsäure (Schmelzpunkt 220–223 °C).[3]

Nachweis
[Bearbeiten | Quelltext bearbeiten]Die Reaktion mit Eisen(III)-chlorid ergibt eine intensive violette Farbe.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 3-Chlorosalicylic acid bei Sigma-Aldrich, abgerufen am 18. März 2011 (PDF).
- ↑ N. W. Hirwe, K. N. Rana, K. D. Gavankar: Derivatives of salicylic acid. In: Proceedings of the Indian Academy of Sciences - Section A. 8, 1938, S. 208–213, doi:10.1007/BF03045504.
- ↑ a b R L Crawford, S W Hutton, P J Chapman: Purification and properties of gentisate 1,2-dioxygenase from Moraxella osloensis. In: Journal of Bacteriology. Band 121, Nr. 3, März 1975, S. 794–799, doi:10.1128/jb.121.3.794-799.1975, PMID 234947, PMC 246005 (freier Volltext).
- ↑ a b N. Walker, G. H. Wiltshire: The decomposition of 1-chloro- and 1-bromonaphthalene by soil bacteria. In: Journal of General Microbiology. 12(3), 1955, S. 478–483, doi:10.1099/00221287-12-3-478, PMID 14392303.
