Cyclopropylmethanol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclopropylmethanol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H8O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 72,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
vollständig mit Wasser mischbar[1] und in vielen organischen Lösungsmitteln löslich[4] | |||||||||||||||
| Brechungsindex |
1,4320 – 1,4330 (20 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclopropylmethanol ist das kleinste Cycloalkan, das eine Hydroxymethylgruppe trägt, die direkt mit der Cyclopropylgruppe verknüpft ist. Von anderen funktionellen Cyclopropanen unterscheidet sich CPMO durch seine ausgeprägte Neigung, unter drastischeren Reaktionsbedingungen durch Ringerweiterung zu Cyclobutanderivaten und/oder Ringöffnung zu linearen Butanderivaten zu reagieren. Die Verbindung ist Ausgangsstoff für pharmazeutische Wirkstoffe und Pflanzenschutzmittel.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Katalytische Hydrierung von Cyclopropancarbaldehyd in Gegenwart von Raney-Nickel oder Raney-Cobalt erzeugt Cyclopropylcarbinol in Ausbeuten bis > 90 % – neben n-Butanol durch Aufspaltung des Cyclopropanrings.[6]
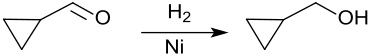
Die Reduktion von Cyclopropancarbonsäure mit Lithiumaluminiumhydrid LiAlH4[7] liefert CPMO, ebenso wie die Hydrierung seiner Ester, z. B. an einem Zinkoxid-Kontakt in fast quantitativer Ausbeute,[8]
Eine Variante der Simmons-Smith-Reaktion mit metallischem Lanthan und Diiodmethan überführt in einer Cyclopropanierungsreaktion Allylalkohol mit 67%iger Ausbeute in Cyclopropanmethanol.[9]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cyclopropanmethanol ist eine klare farblose Flüssigkeit, die sich vollständig mit Wasser und mit vielen organischen Lösungsmitteln, wie z. B. Dimethylformamid, Dichlormethan, oder Tetrahydrofuran mischt.[4]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Synthese von Cyclopropylmethylhalogeniden
[Bearbeiten | Quelltext bearbeiten]Der einfachste Weg von Cyclopropylmethanol zu Cyclopropylmethylbromid wäre die Umsetzung mit wässriger Bromwasserstoffsäure. Allerdings entsteht dabei in 82%iger Gesamtausbeute selbst bei niedrigen Temperaturen (5 bis 10 °C) ein destillativ schwer trennbares Gemisch aus 56 % Cyclopropylmethylbromid (I) (Sdp. 106 °C) neben 37 % Cyclobutylbromid (II) (Sdp. 108 °C) und 7 % 4-Brom-1-buten (III) (Sdp. 100 °C).[10]
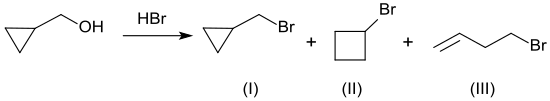
Mildere Prozessvarianten, wie z. B. mit Dimethylsulfid/N-Bromsuccinimid-Komplex[4] oder Triphenylphosphit/Brom[11] liefern zwar wesentlich weniger Nebenprodukte durch Ringerweiterung oder -spaltung, aber auch keine wesentlich besseren Ausbeuten an Cyclopropylmethylbromid (67 bzw. 73 %) neben nicht umgesetztem Ausgangsstoff. Auch die Umsetzung mit Triphenylphosphan/Brom bietet mit 72 % Ausbeute keine Vorteile, da zudem das gefürchtete, weil oft nicht vollständig abtrennbare Triphenylphosphanoxid als Nebenprodukt entsteht.[12] Für dessen Abtrennung aus polaren Lösungsmitteln wurde unlängst die Komplexbildung mit Zinkchlorid vorgeschlagen.[13] Hochreines Cyclopropylmethylbromid, wie es für Synthesevarianten zu pharmazeutischen Wirkstoffen, wie z. B. dem Benzodiazepin Prazepam, dem Betablocker Betaxolol und dem Opioidantagonisten Naltrexon, benötigt wird, ist durch Umsetzung von CPMO in Dimethylformamid mit Triphenylphosphin und einem Überschuss von Brom zugänglich.[14]
Das gegen Umlagerung deutlich stabilere Chlormethylcyclopropan wird bei der Reaktion von Cyclopropylcarbinol mit Dimethylsulfid/N-Chlorsuccinimid in fast quantitativer Ausbeute gebildet,[4] während mit dem milden Chlorierungsmittel Hexachloraceton/Triphenylphosphan[15] Cyclopropylmethylchlorid in 87%iger Ausbeute entsteht.[12]
Die drastischere Umsetzung mit konzentrierter Salzsäure unter Rückfluss (100 °C) führt ebenfalls zur Ringerweiterung und der Bildung von Cyclobutanol in 57%iger Ausbeute.[16]
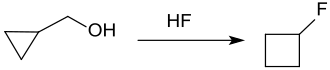
In gleicher Weise reagiert Cyclopropylcarbinol mit wässriger Flusssäure in 98%iger Ausbeute zu Cyclobutylfluorid neben 4-Fluor-1-buten (2 %),[17] d. h. Cyclopropylmethylfluorid wird überhaupt nicht gebildet.
Die Darstellung von Cyclopropylmethylfluorid gelingt hingegen bei der Reaktion von Cyclopropanmethanol mit Diethylaminoschwefeltrifluorid DAST bei −50 °C.[18]
Cyclopropylmethyliodid ist durch Halogenaustausch aus CPMO mit Natriumiodid in Aceton mit 57%iger Ausbeute zugänglich.[19]
Andere Derivate des Cyclopropylmethanols
[Bearbeiten | Quelltext bearbeiten]Cyclopropylmethanol reagiert in einer Eintopfreaktion mit Salzsäure unter Ringerweiterung zum Cyclobutanol und kann anschließend mit Chrom(VI)-oxid mit Ausbeuten von ca. 35 % zum Cyclobutanon oxidiert werden.[20]

Das durch säurekatalysierte Umlagerung von Cyclopropylmethanol entstehende Cyclobutanol reagiert mit para-Toluolsulfonsäurechlorid glatt zum Tosylat. Erhitzen mit Kalium-tert-butanolat in Dimethylsulfoxid DMSO liefert Cyclobuten in Ausbeuten von 70–84 %.[16]

Cyclopropylmethanol wird von Ammoniumcer(IV)-nitrat in wässriger Lösung in 64%iger Ausbeute zu Cyclopropancarbaldehyd oxidiert.[21]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Cyclopropanemethanol bei Alfa Aesar, abgerufen am 8. Februar 2018 (Seite nicht mehr abrufbar).
- ↑ a b c d e Datenblatt Cyclopropanemethanol bei Sigma-Aldrich, abgerufen am 8. Februar 2018 (PDF).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–138.
- ↑ a b c d Patent US6118032: Process for the production of cyclopropylmethyl halides. Angemeldet am 3. August 1999, veröffentlicht am 12. September 2000, Anmelder: Eastman Chemical Co., Erfinder: D.J. Bayston, R.M. Scott, J.M. Lovell, L.A. White.
- ↑ Eintrag zu Cyclopropanemethanol bei TCI Europe, abgerufen am 8. Februar 2018.
- ↑ Patent US5475151: Process for the preparation of cyclopropylmethanol. Angemeldet am 28. November 1994, veröffentlicht am 12. Dezember 1995, Anmelder: Eastman Chemical Co., Erfinder: S. Liang, T.W. Price.
- ↑ Patent US3454575: Quaternary 5-ammonium-methyl-4-amino-2-cycloaliphatylpyrimidine salts. Angemeldet am 6. März 1967, veröffentlicht am 8. Juli 1969, Anmelder: Ciba Corp., Erfinder: R.H. Mizzoni, G. de Stevens.
- ↑ Patent EP0728722A1: Verfahren zur Herstellung von Hydroxymethyl-cyclopropan. Angemeldet am 8. Februar 1996, veröffentlicht am 28. August 1996, Anmelder: Bayer AG, Erfinder: L. Frohn, R. Langer, G. Darsow, E. Zirngiebl, J.-D. Jentsch, B. Pennemann, C. Tiburtius.
- ↑ Y. Nishiyama, H. Tanimizu, T. Tomita: Lanthanum metal-assisted cyclopropanation of alkenes with gem-dihalogenalkanes. In: Tetrahedron Lett. Band 48, Nr. 36, 2007, S. 6405–6407, doi:10.101016/j.tetlet.2007.06.0168j.
- ↑ Patent US6191300B1: Process for the preparation of cyclopropylacetonitrile. Angemeldet am 16. April 1999, veröffentlicht am 20. Februar 2001, Anmelder: Eastman Chemical Co., Erfinder: J.A. Hyatt.
- ↑ Patent US20160355452A1: Method for producing (bromomethyl)cyclopropane and (bromomethyl)cyclobutane. Angemeldet am 1. Dezember 2014, veröffentlicht am 8. Dezember 2016, Anmelder: Melchior Material and Life Science France, Erfinder: O. Guerret.
- ↑ a b R.T. Hrubiec, M.B. Smith: Regioselective route to sterically hindered cyclopropylcarbinyl halides. In: J. Org. Chem. Band 49, Nr. 3, 1984, S. 431–435, doi:10.1021/jo00177a008.
- ↑ D.C. Batesky, M.J. Goldfogel, D.J. Weix: Removal of Triphenylphosphine Oxide by Precipitation with Zinc Chloride in Polar Solvents. In: J. Org. Chem. Band 82, Nr. 19, 2017, S. 9931–9936, doi:10.1021/acs.joc.7b00459.
- ↑ Patent US6008420: Process for the production of halogen methyl cyclopropanes and highly pure halogen methyl cyclopropanes. Angemeldet am 20. August 1998, veröffentlicht am 28. Dezember 1999, Anmelder: Bayer AG, Erfinder: J. Komoschinski, R. Gehring.
- ↑ R.M. Magid: Triphenylphosphine-Hexachloroacetone. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rt373.
- ↑ a b J. Salaün, A. Fadel: Cyclobutene In: Organic Syntheses. 64, 1986, S. 50, doi:10.15227/orgsyn.064.0050; Coll. Vol. 7, 1990, S. 117 (PDF).
- ↑ M. Hanack, H. Eggensperger: Organische Fluorverbindungen, VIII Umsetzung von Cyclopropylcarbinol, Cyclobutanol und Cyclobuten mit Fluorwasserstoff. Darstellung von Fluormethylcyclopropylketon. In: Chem. Ber. Band 96, Nr. 5, 1963, S. 1341–1349, doi:10.1002/cber.19630960525.
- ↑ J.R. Durig, Z. Yu, C. Zheng, G.A. Guirgis: Conformational Studies of Fluoromethylcyclopropane from Temperature-Dependent FT-IR Spectra of Xenon Solutions and Ab Initio Calculations. In: J. Phys. Chem. A. Band 108, Nr. 25, 2004, S. 5353–5364, doi:10.1021/jp0401168.
- ↑ D.H. sieh, C.J. Michejda: Acid-catalyzed decomposition of trialkyltriazenes: Protected alkyldiazonium ions. In: J. Am. Chem. Soc. Band 103, Nr. 2, 1981, S. 442–445, doi:10.1021/ja00392a032.
- ↑ M. Krumpolc, J. Rocek: Cyclobutanone In: Organic Syntheses. 60, 1981, S. 20, doi:10.15227/orgsyn.060.0020; Coll. Vol. 7, 1990, S. 114 (PDF).
- ↑ L.B. Young, W.S. Trahanovsky: Cerium (IV) oxidation of organic compounds. III. Preparation of cyclopropanecarbaldehyde from cyclopropanemethanol. In: J. Org. Chem. Band 32, Nr. 7, 1967, S. 2349–2350, doi:10.1021/jo01282a058.

