ساباکسید
ساباکسیدها (به انگلیسی: suboxides) دستهای از اکسیدها هستند که در آن الکتروپوزیتیوی (اتمی که قادر به از دست دادن الکترون است) عنصر به صورت نسبی بیش از حد اکسیدهای «طبیعی» است.[۱] هنگامی که عنصر الکتروپوزیتیو یک فلز است، گاهی اوقات به عنوان ترکیبات «غنی از فلز» شناخته میشوند؛ به عنوان مثال اکسید طبیعی سزیم Cs2O ، که به صورت یک نمک +Cs از -O2 یافت میشود. یک ساباکسید سزیم Cs11O3 است، که در آن بار Cs به وضوح کمتر از +۱ است، اما اکسید همچنان به عنوان اکسیدی از -O2 توصیف میشود. ساب اکسیدها معمولاً دارای پیوند گسترده بین عنصر الکتروپوزیتیو هستند که اغلب منجر به پیدایش خوشهها میشوند.
نمونههایی از ساب اکسیدها عبارتند از:
- ساباکسید کربن، ؛
- ساباکسید بور، ؛
- ساباکسید روبیدیم، ؛
- ساباکسید سیلیکون، ؛
- ساباکسید تیتانیوم، ؛
- مونوکسید تیتانیوم، ؛[۲]
- ساباکسید تنگستن، .
ساب اکسیدهای حاوی فلز
[ویرایش]ساب اکسیدها ساختار واسطهای هستند که در طول مسیری که اکسیدهای معمولی تشکیل میشوند، به وجود میآیند. ساباکسیدها گاهی هنگامی که فلزات خاصی در معرض مقادیر کمی از O2 قرار میگیرند، قابل مشاهده میشوند:
چندین ساباکسید سزیم و روبیدیم توسط بلورنگاری پرتو ایکس شناسایی شدهاند. در سال ۱۹۹۷، فهرست یافتهها شامل موارد زیر بود:
، ، ، ، ، ، و .[۱]
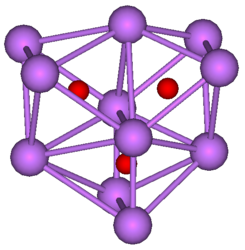
ساباکسیدها معمولاً ترکیبات رنگیاند، که این ویژگی نشان دهنده جهات الکترونهای نامتمرکز در ساختار هستند. Cs7O دارای یک سلول واحد، حاوی یک خوشه Cs11O3 و ۱۰ اتم Cs است. این خوشه را میتوان به صورت خوشهای متشکل از سه هشت وجهی که با یکدیگر در سطحهایشان در اشتراک هستند، تصور کرد. در تصویر زیر اتمهای سزیم بنفش و اتمهای اکسیژن قرمز هستند. فاصله پیوند Cs-Cs در این خوشه است که کمتر از فاصله Cs-Cs در فلز است. Rb9O2 و Rb6O هر دو شامل خوشههای Rb9O2 هستند که میتوان آن را به صورت خوشهای متشکل از دو هشت وجهی که با یکدیگر در سطحهایشان در اشتراک هستند، تصور کرد. Rb6O را میتوان به صورت Rb3(Rb9O2) فرموله کرد. فاصله Rb-Rb در خوشه است که کوتاهتر از Rb-Rb در فلز () است. گفته میشود که ساباکسید سزیم نقش مهمی را در فوتوکاتد و چند فلز قلیایی Rb، K، Na و Cs دارد.[۳]
هنگامی که اکسیژن با دقت زیادی به مذاب سزیم اضافه می شود، رنگ طلایی اصلی فلز به تدریج به رنگ برنزی، بنفش و در نهایت تقریباً سیاه می شود. روبیدیم در همین واکنش از رنگ نقرهای به برنجی و در نهایت به مسی تغییر رنگ می دهد. از مذاب های رنگی روبیدیم و سزیم اکسید شده، ساب اکسیدهای جامد با سرد شدن متبلور می شوند.[۱]

|
|
| خوشه | خوشه |
ساب اکسید کربن
[ویرایش]
این اکسید که با نام ساب اکسید کربن شناخته میشود، که حاوی کربن در حالت اکسیداسیون قراردادی است. از آنجایی که این میزان کمتر از حالت اکسیداسون کربن در حالت CO و CO2 است، این اکسید را ساب اکسید کربن مینامند و دارای یک ساختار ساده و خطی است. ساختاری به همان صورتی که مواد آلی مرتبط با کومولن (به عنوان مثال کتن) دارد. C3O2 از قاعده هشتتایی پیروی میکند.
ساباکسید کربن اگرچه در دماهای پایین پایدار است اما با حرارت دادن پلیمریزه میشود و به راحتی میسوزد.[۴]
ساباکسید تیتانیوم
[ویرایش]اکسیدهای تیتانیوم نیمه رسانای غیر استوکیومتری، یعنی ساباکسیدهای تیتانیوم، نشاندهنده گروهی از مواد با فاصله باند کم هستند. این اکسیدهای تیتانیوم حاوی جای خالی ساختاری در زیرشبکههای تیتانیوم و اکسیژن با فرمول کلی TinO2n-1 است، که در آن n ≥ 2 میباشد. نتایج تجربی نشان دادهاند که مقدار n معمولاً بین 3، 6و 10 تغییر میکند، اگرچه مقادیر بالاتری از n نیز گزارش شده است.[۲]
ساباکسید بور
[ویرایش]اولین سنتز آزمایشگاهی الماس در سال 1954، تلاش های گسترده ای را برای طراحی و توسعه موادی با خواص نزدیک به الماس یا حتی بهبود یافته نسبت به آن را آغاز کرد. جامدات غنی از بور نامزدهای خوبی برای این منظور شدند. ترکیباب بور، خانواده بزرگی از ترکیبات دیرگداز هستند که با ساختارهای کریستالی منحصر به فرد که مربوط به طول پیوند بین اتمی کوتاه و ویژگی قوی کووالانسی آنها است، دارای طیف وسیعی از خواص فیزیکی و شیمیایی جالب هستند. فازهای غنی از بور شامل کاربید بور و ساباکسید بور (B6O) است که سختی بالا را با چگالی کم و بی اثری شیمیایی ترکیب می کند و آنها را به عنوان ساینده و سایر کاربردهای با سایش بالا مفید میکند.
علاوه بر این، این ترکیبات دارای خواص گرمایی و الکترونیکی بالقوه مفیدی برای تولید نیروی ترموالکتریک در دمای بالا هستند. سابوکسید بور به عنوان یک "فاز فوق سخت" دارای ریزسختی و خواص سایش قابل مقایسه با الماس است. برخی از مطالعات، ساباکسید بور را سخت تر از کاربید بور گزارش می کنند، در حالی که برخی دیگر خلاف این را گزارش می کنند. مطالعه خواص B6O به دلیل این واقعیت که مواد خالص با درجه بلورینگی بالا به سختی سنتز می شوند، مشکل است.[۵]
ساب اکسید سیلیکون
[ویرایش]رابط سیلیکون-سیلیکون دی اکسید نقش مهمی در فناوری نیمه هادی ایفا می کند و برای مدت طولانی مورد مطالعه قرار گرفته است. دلیل علاقه به مطالعه جایگاه و خواص SiOx نه تنها برای تحقیقات آکادمیک است، بلکه برای درک بهتر شکلگیری و ساختار روابط Si-SiO2 مفید میباشد و میتواند به بهبود ساختارهای نازک اکسید های فلزی نیمه رسانا (MOS) کمک کند. علاوه بر این، لایههای SiOx تعبیهشده در ساختار سیلیکون تک کریستالی (c-Si) میتواند راهی برای بهبود خواص ترموالکتریک Si باشد، زیرا انتظار میرود لایههای نازک SiOx هدایت حرارتی را کاهش دهند، اما همچنان رسانایی الکتریکی بالایی را ممکن میسازند و بنابراین نیاز به مواد ارزان قیمت و در دسترس برای مواد ترموالکتریک با دمای بالا را برآورده می کند.
سیلیکون ساباکسید تقریباً به طور انحصاری در رابط ساختارهای Si/SiO2 مورد مطالعه قرار گرفته است. ساختار اتمی و شکل کریستالی SiOx بحث برانگیز است. به منظور توضیح ساختارهای کریستالی رابط بین Si/SiO2، چندین گروه مدلهای مختلفی را برای رابط بین آنها مانند تریدیمیت، کریستوبالیت یا کوارتز و همچنین ساختارهای غیر بلوری مانند شبکه پیوند پل مورد بحث و بررسی قرار دادهاند.[۶]
لینک های خارجی
[ویرایش]- الکترودهای مبتنی بر اکسیدهای تیتانیوم فاز Magnéli
- پیشرفت تحقیقات آندهای مبتنی بر ساب اکسید سیلیکون برای باتری های لیتیوم یونی
- سنتز پودر ساباکسید بور برای سرامیک های با سختی فوق العاده بالا
- Boron suboxide
منابع
[ویرایش]- ↑ ۱٫۰ ۱٫۱ ۱٫۲ Simon, A. ”Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels” Coordination Chemistry Reviews 1997, volume 163, Pages 253–270.doi:10.1016/S0010-8545(97)00013-1
- ↑ ۲٫۰ ۲٫۱ Jagminas, Arūnas; Ramanavičius, Simonas; Jasulaitiene, Vitalija; Šimėnas, Mantas (2019). "Hydrothermal synthesis and characterization of nanostructured titanium monoxide films". RSC Advances (به انگلیسی). 9 (69): 40727–40735. doi:10.1039/C9RA08463K. ISSN 2046-2069.
- ↑ Oxides: solid state chemistry, WH McCarrroll Encyclopedia of Inorganic chemistry. Editor R Bruce King, John Wiley and Sons. (1994) شابک ۰−۴۷۱−۹۳۶۲۰−۰
- ↑ «Carbon Suboxide - an overview | ScienceDirect Topics». www.sciencedirect.com. دریافتشده در ۲۰۲۱-۱۱-۲۸.
- ↑ Hubert, Hervé; Garvie, Laurence A. J.; Devouard, Bertrand; Buseck, Peter R.; Petuskey, William T.; McMillan, Paul F. (1998-06-01). "High-Pressure, High-Temperature Synthesis and Characterization of Boron Suboxide (B6O)". Chemistry of Materials. 10 (6): 1530–1537. doi:10.1021/cm970433+. ISSN 0897-4756.
- ↑ Pohl, Christoph; Raab, Nicolas; Mitterer, Martin; Tarakina, Nadezda; Breuer, Uwe; Brunner, Karl (2014-03-01). "Multilayer structures of silicon-suboxide embedded in single crystal silicon". Journal of Crystal Growth (به انگلیسی). 389: 12–17. doi:10.1016/j.jcrysgro.2013.11.073. ISSN 0022-0248.