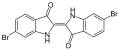
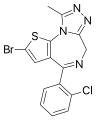
Organobromuro

Gli organobromuri, detti anche bromuri organici o composti organobromurati, sono un'ampia categoria di composti organici che contengono almeno un legame covalente carbonio-bromo, o più raramente azoto-bromo.[1] Uno dei più semplici è il bromoformio, un composto di origine naturale prodotto da piante e animali marini in quantità valutate in 1-2 milioni di tonnellate all'anno.[2][3]
I composti organobromurati trovano impiego in molte applicazioni, tra le quali la più importante è l'uso come ritardanti di fiamma. Altri impieghi riguardano prodotti per il trattamento delle acque, farmaci, disinfettanti, coloranti, erbicidi, pesticidi, e altri composti organici commerciali.[1]
Proprietà generali
[modifica | modifica wikitesto]In generale le proprietà dei composti organobromurati risultano intermedie rispetto a quelle dei corrispondenti organocloruri e organoioduri. Per molte applicazioni, gli organobromuri rappresentano un compromesso tra reattività e costo.
La maggior parte dei composti organobromurati sono poco polari, al pari della maggior parte dei composti organici alogenati. Il bromo è più elettronegativo del carbonio, e di conseguenza l'atomo di carbonio connesso al bromo è elettrofilico; in altre parole i bromuri alchilici sono agenti alchilanti.
Le principali reazioni per gli organobromuri includono sostituzione nucleofila, uso come reattivi di Grignard e deidrobromurazione (eliminazione di HBr).[1]
Presenza in natura
[modifica | modifica wikitesto]Sono stati isolati da fonti naturali più di 2000 organobromuri, che risultano i composti organici alogenati più diffusi in natura. Sono abbondanti soprattutto in piante e animali marini, ma sono stati isolati anche in funghi, batteri, piante, insetti e perfino in mammiferi e nell'uomo.[2] Negli organismi marini i composti organobromurati risultano più abbondanti di quelli organoclorurati, nonostante che la concentrazione di bromo nel mare sia solo lo 0,3% di quella del cloro. L'abbondanza dei composti bromurati è dovuta alla facilità con cui il bromo può essere ossidato a Br+, un potente elettrofilo. Nell'ambiente marino questa ossidazione è catalizzata dalla vanadio bromoperossidasi, un enzima facente parte del gruppo delle bromoperossidasi.[4] Si calcola che negli oceani vengano prodotte ogni anno 1-2 milioni di tonnellate di bromoformio e 56.000 tonnellate di bromometano.[2] Composti organobromurati si trovano in natura anche in scisti bituminosi e sedimenti marini, presumibilmente formati dal decadimento di antichi organismi. La presenza di bromometano è stata riscontrata anche in eruzioni vulcaniche.[2]

Prodotti organobromurati sono presenti nell'ambiente anche in seguito alla biodegradazione dei ritardanti di fiamma. I metaboliti includono bromuri arilici metossilati e idrossilati nonché derivati di diossine bromurate. Tali composti sono considerati inquinanti organici persistenti e sono stati trovati anche nei mammiferi.
Sintesi
[modifica | modifica wikitesto]Con bromo
[modifica | modifica wikitesto]Gli alcheni addizionano bromo senza bisogno di catalizzatori e formano dibromuri vicinali:
I composti aromatici addizionano bromo con simultaneo rilascio di bromuro di idrogeno. Per far reagire anelli aromatici sono necessari catalizzatori come AlBr3 o FeBr3. Si potrebbero usare anche gli analoghi cloruri (AlCl3 e FeCl3), ma la resa sarebbe minore perché si potrebbero formare dialogeni BrCl. La reazione avviene con il meccanismo della sostituzione elettrofila aromatica:
Per preparare composti organobromurati si possono usare anche reazioni radicaliche. I substrati benzilici e allilici contenenti il gruppo carbonile sono particolarmente inclini a questa reazione. Ad esempio l'acido bromoacetico viene sintetizzato direttamente da acido acetico e bromo in presenza di tribromuro di fosforo come catalizzatore:[1]
Il bromo converte anche trifluorometano in bromotrifluorometano.
Con bromuro di idrogeno
[modifica | modifica wikitesto]Il bromuro di idrogeno si addiziona ai doppi legami seguendo la regola di Markovnikov per dare alchilbromuri:
In condizioni radicaliche si può invertire il senso dell'addizione. Industrialmente si usa l'addizione radicalica per la sintesi di 1-bromoalcani, precursori di ammine terziarie e sali di ammonio quaternari. Per questa via si ottiene 1-bromo-2-feniletano (C6H5CH2CH2Br) da stirene.[1]
Il bromuro di idrogeno può convertire anche alcoli in alchilbromuri. Questa reazione, che deve essere condotta a bassa temperatura, si usa industrialmente per la sintesi di bromuro di allile, utile poi per ottenere erbicidi e farmaci:[1]
Il bromometano si ottiene da metanolo e bromuro di idrogeno.
Con bromuri salini
[modifica | modifica wikitesto]Gli ioni bromuro, forniti da sali come il bromuro di sodio, possono agire da nucleofili per formare organobromuri in reazioni di sostituzione.[5] Un esempio dell'impiego di sali bromurati è la reazione del bromuro di rame(II) con i chetoni:[6]
Applicazioni
[modifica | modifica wikitesto]Ritardanti di fiamma
[modifica | modifica wikitesto]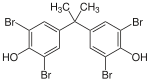
I composti organobromurati sono ampiamente usati come ritardanti di fiamma. Nel 2012 erano utilizzati più 80 composti di questo tipo. Uno dei più usati è il TBBPA (tetrabromobisfenolo). Nuovi ritardanti di fiamma bromurati vengono continuamente sviluppati via via che alcuni di questi composti vengono banditi dal mercato in quanto inquinanti persistenti.[1]
Fumiganti e biocidi
[modifica | modifica wikitesto]Il 1,2-dibromoetano, in passato usato come additivo nella benzina con piombo, era anche un fumigante usato in agricoltura. Questi usi sono però cessati per motivi ambientali e sanitari. Anche il bromometano sarebbe un efficace fumigante, ma il suo utilizzo in agricoltura minaccia lo strato di ozono e l'impiego è ora vietato dal Protocollo di Montréal.
I composti organobromurati sono invece sempre più usati come biocidi per il trattamento delle acque, anche se quelli basati sul cloro continuano a dominare il mercato. Esempi di composti usati per il trattamento delle acque sono BCDMH (1-bromo-3-cloro-5,5-dimetilimidazolidin-2,4-dione) e DBDMH (1,3-dibromo-5,5-dimetilimizadolidin-2,4-dione).[1]
-
1,2-dibromoetano
-
Bromometano
-
BCDMH
-
DBDMH
Coloranti
[modifica | modifica wikitesto]La porpora di Tiro (6,6'-dibromoindigo) è un colorante di origine naturale, molto apprezzato prima dello sviluppo dell'industria dei coloranti sintetici alla fine del XIX secolo. Esistono svariati coloranti artificiali contenenti bromo, usati per tingere tessuti, plastiche, carta e cosmetici; alcuni esempi sono il Vat Orange 3 (un derivato dell'antrachinone) e la Eosina B (un derivato dello xantene). Alcuni coloranti bromurati sono usati come indicatori in chimica analitica; ben noto è il blu di bromotimolo.[1]
-
Porpora di Tiro
-
Vat Orange 3
-
Eosina B
-
Blu di bromotimolo
Farmaci
[modifica | modifica wikitesto]Gli organobromuri sono alla base di numerosi farmaci. Alcuni esempi sono il vasodilatatore nicergolina, il sedativo brotizolam, l'antitumorale pipobroman e l'antisettico merbromina. Esistono inoltre farmaci che contengono lo ione bromuro come semplice controione senza alcuna attività farmacologica.[1]
-
Nicergolina
-
Brotizolam
-
Pipobroman
-
Merbromina
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) J. N. Carter-Franklin e A. Butler, Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products, in J. Am. Chem. Soc., vol. 126, n. 46, 2004, pp. 15060–15066, DOI:10.1021/ja047925p.
- (EN) G. W. Gribble, The diversity of naturally occurring organobromine compounds, in Chem. Soc. Rev., vol. 28, n. 5, 1999, pp. 335-346, DOI:10.1039/A900201D.
- (EN) G. W. Gribble, The Natural Production of Organobromine Compounds, in Environ. Sci. & Pollut. Res., vol. 7, n. 1, 2000, pp. 37-49, DOI:10.1065/espr199910.002.
- (EN) L. C. King e G. K. Ostrum, Selective Bromination with Copper(II) Bromide, in J. Org. Chem., vol. 29, n. 12, 1964, pp. 3459–3461, DOI:10.1021/jo01035a003.
- (EN) J.S. Nowick e G. Lutterbach, Sodium Bromide, in Encyclopedia of Reagents for Organic Synthesis, 2001, DOI:10.1002/047084289X.rs054.
- (EN) D. Yoffe, R. Frim, S. D. Ukeles, M. J. Dagani e altri, Bromine Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2013, DOI:10.1002/14356007.a04_405.pub2.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su organobromuro
Wikimedia Commons contiene immagini o altri file su organobromuro
| Controllo di autorità | J9U (EN, HE) 987007550940805171 |
|---|