リーシュマニア
| リーシュマニア | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
マクロファージ中で増殖した Leishmania tropica の無鞭毛型(矢印)
| ||||||||||||||||||||||||||||||
| 分類 | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| 学名 | ||||||||||||||||||||||||||||||
| Kinetoplastea Honigberg, 1963 | ||||||||||||||||||||||||||||||
| シノニム | ||||||||||||||||||||||||||||||
|
Kinetoplastida Honigberg, 1963 | ||||||||||||||||||||||||||||||
| 亜属 | ||||||||||||||||||||||||||||||
|
リーシュマニア (Leishmania) は、トリパノソーマ科に属する原生生物で、脊椎動物の細胞内に寄生してリーシュマニア症を引き起こす。
名はイギリス陸軍軍医のウィリアム・リーシュマン (William Leishman, 1865–1926) に因む。
この原虫はサシチョウバエ類によって媒介されるが、特に旧世界では Phlebotomus 属、新世界では Lutzomyia 属のものが知られている。主要な宿主は哺乳動物であり、ヒトのほかにげっ歯類、イヌなどにおいて感染の報告が多くなされている。
生活環
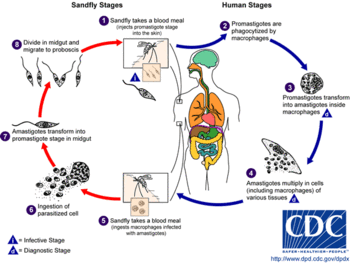
リーシュマニアは2つの形態学的なステージを持っている:
- 前鞭毛型 (promastigote)
- 媒介昆虫内。鞭毛を持つ。
- 無鞭毛型 (amastigote)
- 哺乳動物細胞内。鞭毛がない。
サシチョウバエの雌に刺されると、
- 特に発育終末前鞭毛型 (metacyclic promastigote) と呼ばれるリーシュマニアが体内に侵入する。
- 刺傷周辺の組織でマクロファージに貪食され、
- その中で無鞭毛型に変態する。
- 無鞭毛型は細胞内で増殖し、種によって異なる組織に病変を生じ、これによって症状の差が現れる。
- サシチョウバエは吸血の際に無鞭毛型に感染したマクロファージを取り込み、
- これを消化することで感染する。
- サシチョウバエの中腸で前鞭毛型に分化し(7)、
- 増殖した後に発育終末前鞭毛型に分化して口吻へ移動する。
起源
リーシュマニアの起源ははっきりわかっていない[1][2]。ある説によれば、アフリカ起源でアメリカに伝わり、さらに約1500万年前に陸地化していたベーリング海峡を渡って旧世界に渡ったとされる。しかし旧北区起源だとする説もある[3]。原虫の伝播には媒介昆虫や保有宿主の伝播やそれに引き続く適応が伴っているはずである。もっと新しい伝播として、ヨーロッパ各国による新世界の植民地化に伴い、地中海沿岸の L. infantum がラテンアメリカに渡って L. chagasi と呼ばれるようになったケースが判っている。
分類
リーシュマニア属の原虫は30種あまりが知られているが、その多くは以下の3つの亜属に分類することができる。もともとサシチョウバエ体内での寄生部位によって区別されたものだが、分子系統解析でもほぼ単系統となっている[4]。この3亜属(Euleishmania と総称する)とは別に、Paraleishmania と総称される種が知られている。
Euleishmania
Leishmania 亜属
Leishmania 亜属(subgenus Leishmania Ross[5], 1903)は、サシチョウバエの前腸・中腸(幽門より前)で発達する。旧世界で放散した生物群だと考えられる。
- donovani コンプレックス - 主に内臓リーシュマニア症を引き起こす病原体で、以下の2種に整理されている。
- tropica コンプレックス - 旧世界における皮膚リーシュマニア症の病原体。
- mexicanaコンプレックス - 中米における皮膚リーシュマニア症の病原体。
- その他
Viannia 亜属
Viannia 亜属(subgenusViannia Lainson et Shaw, 1987)は、幽門前後で発達する(後腸に寄生する時期がある)ことにより分けられた。新世界で放散した生物群だと考えられる。主に皮膚リーシュマニア症を引き起こす病原体で、粘膜皮膚型とよばれる重篤な症状を示すことが多い。
- ブラジルリーシュマニア L. (V.) braziliensis Vianna, 1911
- ペルーリーシュマニア L. (V.) peruviana Velez, 1913
- ガイアナリーシュマニア L. (V.) guyanensis Floch, 1954
- パナマリーシュマニア L. (V.) panamensis Lainson et Shaw, 1972
- L. (V.) lainsoni Silveira et al., 1987
- L. (V.) shawi Lainson et al., 1989
- L. (V.) naiffi Lainson et Shaw, 1989
Sauroleishmania 亜属
Sauroleishmania 亜属(subgenus Sauroleishmania Saf'janova, 1982)は爬虫類に寄生し、サシチョウバエ体内では後腸(幽門より後)で発達するもの。爬虫類に寄生することから別属に分けられたが、現在ではリーシュマニア属の亜属として扱うことが多い。
- L. (S.) tarentolae Wenyon, 1921
- L. (S.) gymnodactyli Khodukin et Sofiev, 1940
- L. (S.) adleri Heisch, 1958
- L. (S.) hoogstraali McMillan, 1965
- L. (S.) guliki Saf'janova, 1982
Paraleishmania
アイソザイム解析や分子系統解析で、Euleishmania3亜属のすぐ外側の系統に属する生物群である[7]。中南米の様々な動物から見出され、ヒトに感染するものも含まれている。また分子系統解析では Endotrypanum 属がここに含まれており、その解釈に関して議論がある。
- L. enrietti Muniz et Medina, 1948 - ブラジルのモルモットから発見された。
- L. hertigi Herrer, 1971
- L. deanei Lainson et Shaw, 1977
- L. herreri Zeledon et al., 1979
- L. colombiensis Kreutzer et al., 1991
- L. equatorensis Grimaldi et al., 1992
その他
- L. (L.) forattinii Yoshida et al., 1993
歴史
誰が最初にリーシュマニア症の病原体を見つけたのかについては議論がある。イギリス領インド軍の軍医少佐デービッド・カニンガム (David D. Cunningham) が1885年に観察しているが病気との関連性には気付いていなかった[8][9]。1901年になって、ウィリアム・リーシュマン (William Leishman) がダムダム熱で死んだ患者の脾臓塗布標本にこの生物を認め、1903年にチャールズ・ドノヴァンが新種記載を行った[10]。その後、ロナルド・ロスがこの生物と病気との関連性を認め、Leishmania donovani という学名を与えた。
分子生物学
リーシュマニアで重要なのは、リポフォスフォグリカン(LPG)による複合糖質層である。これはフォスフォイノシチド膜アンカーと結合し、脂質・中性糖鎖・リン酸化されたガラクトース=マンノースの繰り返しという3部構造を持ち、末端は中性オリゴ糖でキャップされている。サシチョウバエに消化される時だけでなく、呼吸バースト(爆発的な活性酸素種発生)に対応し感染を継続させるのにも役立っていると考えられている。細胞内消化はエンドソームがリソソームと融合して加水分解酵素が放出され、DNA、RNA、タンパク質や炭水化物を消化する。
Leishmania major のゲノムが解読されている[11]。
感染機序
微生物が感染すると、多形核白血球(PMN)は血管上皮をすり抜けて血流中から感染の起きている組織へと脱出する。そこで直ちに最初の免疫応答としての仕事をはじめ、侵入者を貪食する。この過程で炎症が起きる。活性化されたPMNはケモカイン(特にIL-8)を分泌して他の顆粒球を呼び寄せその貪食作用を活性化させる。L. majorはPMNのIL-8分泌をさらに増大させる。これは不合理に感じるかもしれないが、この現象は他の偏性細胞内寄生体でも観察される。この手の微生物にとって、細胞内で生き残る方法は何通りかある。驚くことに、アポトーシスを起こした病原体を生きた病原体と一緒に打つと、生きた病原体だけを打った場合よりも爆発的な病態を示す。死んだ寄生虫の表面に通常アポトーシスを起こした細胞が持っている抗炎症シグナルであるフォスファチジルセリンを晒すと、L. majorは呼吸バーストを止め、同時に打った生きた病原体の殺傷分解は達成されない。リーシュマニアの場合、子孫はPMNの中では作られないが、この方法で生き残り感染部位に自由に居続けることができる。
前鞭毛型はさらにリーシュマニア化学遊走因子 (Leishmania chemotactic factor; LCF) を分泌し、好中球を活発に誘引するが、しかし単球やNK細胞のような他の白血球は誘引しない。さらにリーシュマニアが存在するとPMNによるインターフェロンガンマ誘導タンパク質10(IP10)の産生は止められ、NK細胞やTh1細胞の誘引による炎症反応と防御免疫反応が遮断される。最初の宿主であるPMNがACAMP (apoptotic cell associated molecular pattern) という「病原体がいない」というシグナルを提示しているため、この病原体は貪食作用の間も生存したままである。
好中球の寿命はとても短く、骨髄から出て血流中を6~10時間循環したのち、自発的にアポトーシスを起こす。病原微生物はそれぞれ異なる戦略で細胞のアポトーシスに影響を与えることが報告されている。L. major は caspase 3 の活性化を阻害することで、好中球のアポトーシスを遅らせ寿命を2~3日引き延ばすことができる。この寄生虫の最終的な宿主はマクロファージで、感染部位にたどり着くのに通常2~3日かかるため、この寿命の延長は感染の進展には非常に有利である。この病原体はものぐさではなく、むしろ初感染部位における指揮権をつかんでしまう。PMNによるMIP-1αとMIP-1ß (macrophage inflammatory protein) というケモカインの産生を誘導してマクロファージを呼び寄せる。
好中球が含む有害な細胞成分やタンパク質分解酵素から周囲の組織を守るために、アポトーシスを起こしたPMNはマクロファージによって静かに除去される。死にゆくPMNは「食べて」信号、すなわちアポトーシス中細胞膜の外側に輸送されるフォスファチジルセリンを提示している。遅延されたアポトーシスのためPMNに残存している原虫はマクロファージに取り込まれるが、これは全く生理的な過程であり炎症反応ではない。この「静かな食作用」という戦略は原虫にとって次のような利点がある。
- アポトーシスした細胞の取り込みは、マクロファージの殺傷活性を抑え、病原体の生存につながる。
- アポトーシスした細胞内部の原虫は見えないので、PMN内部の病原体はマクロファージ表面の受容体と直接接触しない。したがってマクロファージによる免疫の活性化も起こらない。
出典
- ^ Momen H, Cupolillo E (2000). “Speculations on the origin and evolution of the genus Leishmania”. Mem. Inst. Oswaldo Cruz 95 (4): 583-8. PMID 10904419.
- ^ Noyes HA, Morrison DA, Chance ML, Ellis JT (2000). “Evidence for a neotropical origin of Leishmania”. Mem. Inst. Oswaldo Cruz 95 (4): 575-8. PMID 10904417.
- ^ Kerr SF (2000). “Palaearctic origin of Leishmania”. Mem. Inst. Oswaldo Cruz 95 (1): 75-80. PMID 10656708.
- ^ Yurchenko, V.Y., et al. (2006). “Leptomonas costaricensis sp. n. (Kinetoplastea: Trypanosomatidae), a member of the novel phylogenetic group of insect trypanosomatids closely related to the genus Leishmania”. Parasitology 133 (10): 537-546. doi:10.1017/S0031182006000746.
- ^ ジョン・ロス(1777-1856) 北極探検家 or Herbert H. Ross アメリカの昆虫学者
- ^ ジョン・ロス(1777-1856) 北極探検家 or Herbert H. Ross アメリカの昆虫学者
- ^ Cupolillo, E., et al (2000). “A Revised Classification for Leishmania and Endotrypanum”. Parasitology Today 16 (4): 142-144. doi:10.1016/S0169-4758(99)01609-9.
- ^ Cunningham, DD (1885). On the presence of peculiar parasitic organisms in the tissue of a specimen of Delhi boil. Scientific memoirs officers Medical Sanitary Departments Government India. Calcutta: Printed by the superintendent of government printing, India. pp. 21–31. OCLC 11826455
- ^ Cox FE (2002). “History of human parasitology”. Clin. Microbiol. Rev. 15 (4): 595-612. PMID 12364371.
- ^ “WHO: Leishmaniasis: background information”. 2007年7月4日閲覧。
- ^ Ivens AC, et al. (2005). “The genome of the kinetoplastid parasite, Leishmania major”. Science 309 (5733): 436–42. PMID 16020728.
参考文献
- van Zandbergen, G. et al. (2006). “Leishmania disease development depends on the presence of apoptotic promastigotes in the virulent inoculum.”. Proc. Natl. Acad. Sci. 103 (37): 13837-13842. doi:10.1073/pnas.0600843103.
- Laskay, T., van Zandbergen, G. and Solbach, W. (2003). “Neutrophil granulocytes - Trojan horses for Leishmania major and other intracellular microbes?”. Trends in Microbiology 11 (5): 210-214. doi:10.1016/S0966-842X(03)00075-1.