Disproporcionacija
Videz
Izraz disproporcionacija se v kemiji uporablja za opis dveh vrst kemijskih reakcij:[1]
- kemijske reakcije s splošno enačbo
- 2A → A' + A",
- v kateri so A, A' in A" različne kemijske spojine. Večina disproporcionacij spada med redoks reakcije, vendar so možne tudi reakcije, na primer disociacija vode
- 2H2O → H3O+ + OH-,
- ki ni redoks reakcija.
- Kemijske reakcije, reverzibilne ali ireverzibilne, v katerih se spojine istočasno reducirajo in oksidirajo in tvorijo dva različna produkta. Takšna je, na primer, Cannizzarova reakcija, v kateri se del aldehida oksidira v karboksilno kislino, drug del pa se reducira v alkohol.
Disproporcionaciji nasprotna reakcija je komproporcionacija.
Zgodovina
[uredi | uredi kodo]Prva preučena disproporcionacija je bila reakcija
- 2Sn2+ → Sn + Sn4+
Reakcijo je s pomočjo estrov vinske kisline preučil finski kemik, fizik in mineralog Johan Gadolin leta 1788.[2]
Primeri
[uredi | uredi kodo]- Plinasti klor reagira z natrijevim hidroksidom, pri čemer nastane natrijev klorid, natrijev klorat in voda:[3]:
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
- V reakciji se del elementarnega klora reducira iz oksidacijskega stanja 0 v kloridni ion z oksidacijskim stanjem -1, drugi del pa se oksidira v kloratni ion, v katerem ima klor oksidacijsko stanje +5:
- 3Cl20 → 5Cl- + Cl5+
- Disproporcionacija superoksidnega prostega radikala v vodikov peroksid in kisik, ki ga v živih organizmih katalizira encim superoksidna dismutaza:
- 2O2− + 2H+ → H2O2 + O2
- Atomska skupina O2 v superoksidnem anionu ima oksidacijsko stopnjo -1, v vodikovem peroksidu -2, elementarni kisik pa 0.
- V Cannizzarovi reakciji se aldehid pretvori v alkohol in karboksilno kislino:
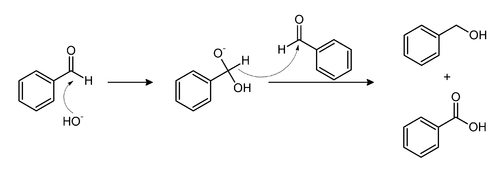
- V sorodni Tiščenkovi reakciji nastane odgovarjajoči ester:

- V Kornblum–DeLaMareovi prerazporeditvi se peroksid pretvori v keton in alkohol:

- Disproporcionacijo vodikovega peroksida v vodo in kisik katalizira encim katalaza:
- 2H2O2 → 2H2O + O2
- Boudouardova reakcija, v kateri pride do disproporcionacije ogljikovega monoksida, je ena od metod za proizvodnjo ogljikovih nanocevk:
- 2CO → C + CO2
- Reakcija poteka pri visokem tlaku na površini železnih delcev, ki služijo kot katalizator.
Reference
[uredi | uredi kodo]- ↑ International Union of Pure and Applied Chemistry. "disproportionation". Compendium of Chemical Terminology Internet edition.
- ↑ K. Sv. Vet. Acad. Handl. 1788, 186-197; Crells chem. Annalen 1790, I, 260-273
- ↑ Charlie Harding, David Arthur Johnson, Rob Janes, (2002), Elements of the P Block, Published by Royal Society of Chemistry, ISBN 0854046909