Tautomērija
Tautomērija (grieķu: ταύτίς (tauto) — 'tas pats', μέρος (meros) — 'daļa') ir izomērijas paveids, kad divi vai vairāki vielas izomēri viegli un atgriezeniski pāriet cits citā (to sauc arī par dinamisko izomēriju). Šādus izomērus sauc par tautomēriem. Tautomērā līdzsvara stāvoklī viela vai tās šķīdums vienlaicīgi satur visu izomēru molekulas noteiktās attiecībās. Tautomērija sevišķi izplatīta organiskajām vielām. Tautomērijas gadījumā visbiežāk notiek ūdeņraža atoma pārvietošanās no viena molekulas atoma pie cita un atpakaļ. Bieži iespējams iegūt stabilus atsevišķus atvasinājumus abām vielas tautomērajām formām.
Neorganisko vielu tautomērija
[labot šo sadaļu | labot pirmkodu]Neorganiskajām vielām tautomērija raksturīga ciānūdeņraža atvasinājumiem. Jau pati ciānūdeņražskābe eksistē divās tautomērās formās:
Istabas temperatūrā tautomērais līdzsvars novirzīts pa kreisi, t.i., galvenokārt HCN veidošanās virzienā; izociānūdeņradis HNC ir daudz mazāk stabils (un vairāk toksisks).
Analoģiskas pārvērtības pazīstamas ciānskābei, kura viegli pāriet izociānskābē:
Gan ciānskābei, gan izociānskābei viegli iegūt atsevišķus sāļus un esterus (cianātus un izocianātus). Interesanti, ka šeit iespējams vēl trešais struktūrizomērs — sprāgstošā skābe H−C≡N→O, kura nav pieskaitāma pie tautomēriem, jo patvaļīgi nepārvēršas citās formās.
Cits piemērs ir hidrogēnsulfītjons, kas ir divu tautomēru maisījums. Vienam izomēram protons (ūdeņradis) pievienojies pie centrālā sēra atoma, bet otram — pie skābekļa atoma:[1]
- [H−OSO2]− ⇄ [H−SO3]−
Arī abām hidrogēnsulfīta tautomērajām formām iegūti atvasinājumi.[2]
Organisko vielu tautomērija
[labot šo sadaļu | labot pirmkodu]Organiskajā ķīmijā vispazīstamākā no daudzajām tautomērijas formām ir ketonu-enolu tautomērija, kurā notiek karbonilsavienojumu (ketonu vai aldehīdu) dinamiska pāreja enolos (savienojumos ar hidroksilgrupu pie dubultsaites). Arī šeit notiek protona migrācija:

Šajā tautomērijas formā līdzsvars parasti ļoti stipri nobīdīts karbonilsavienojuma rašanās virzienā un enolu saturs tajos ir tikai 0,01—0,0001%.[3] Piemēram, acetaldehīds vienmēr satur niecīgu daudzumu vinilspirta:

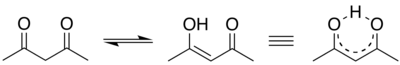
Atsevišķos gadījumos enolformas var būt daudz stabilākas. Acetilacetonam metanola šķīdumā enolformas saturs ir pat 72%.[4] Tas izskaidrojams ar ūdeņraža saites veidošanos starp enolformas hidroksilgrupas ūdeņraža atomu un tuvumā esošās otras karboksilgrupas skābekļa atomu, kam ir enolformu stabilizējoša iedarbība:
Svarīgs tautomērijas paveids ir virknes-cikla tautomērija, kas sevišķi raksturīga ogļhidrātiem. Piemēram, glikozes šķīdumā tikai 0,0026% molekulu ir virknes formā:

Tautomērija bieži novērojama heterociklisko savienojumu atvasinājumiem. Timīnam ir veseli seši tautomēri:

Ar tautomērijas parādību saistīti daudzi ķīmijas tehnoloģijas procesi, īpaši organiskās sintēzes jomā. Liela loma tautomērijai ir arī dzīvos organismos norisošos bioķīmiskajos procesos.
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ Catherine E. Housecroft, Alan G. Sharpe. «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson, 2008. 520. lpp. ISBN 978-0-13-175553-6.
- ↑ N.Ahmetovs. Neorganiskā ķīmija, Rīga, "Zvaigzne", 1978, 335. lpp.
- ↑ O. Neilands. Organiskā ķīmija. R:, Zvaigzne, 1977, 291. lpp.
- ↑ O. Neilands. Organiskā ķīmija. R:, Zvaigzne, 1977, 473. lpp.
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: tautomērija |
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |